Неполярные Растворители
Полярные и неполярные растворители – рассмотрим природу веществ
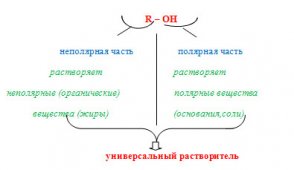
Полярные растворители – это химические соединения, молекула которых является диполем. Все полярные представители в своей молекуле имеют донорные атомы, но при этом подразделяются на содержащие подвижные протоны или протонные (воду, карбоновые кислоты, амины), а также не содержащие такие протоны, другое название апротонные (кетоны, простые эфиры, а также третичные амины).
К достоинствам полярных растворителей можно отнести:
- способность к образованию водородных связей;
- содержание кислого протона;
- способность к стабилизации ионов: катионов – за счет неподеленной пары электронов; анионов – за счет полученных водородных связей.
- высокая диэлектрическая проницаемость;
- способность растворять различные полярные органические вещества;
- широкие температурные пределы жидкого состояния.
Наиболее известными и часто используемыми представителями этого класса являются вода, метиловый спирт, глицерин.
Неполярные вещества – это соединения, молекула которых диполем не является. Они не растворяют соли и основания, часто в реакциях выступающих нуклеотидными реагентами. Поэтому в таких случаях данные растворители применяются редко. Также они имеют низкую температуру кипения, что не позволяет их использовать в реакциях с термическим возбуждением молекул.
Неполярные смеси великолепно растворяют неполярные молекулы газов. Это свойство достаточно широко используется для получения сжатых газов, структура которых крайне неустойчива и опасна, но в растворенном состоянии они прекрасно транспортируются и хранятся в стальных баллонах. Наиболее известные растворители данного класса – это ацетон, уайт-спирит, бензол.
Области применения растворителей
Из всего выше написанного можно сделать вывод, что полярность растворителей играет очень важную роль в определении их свойств. Существует негласное правило применения данных растворителей: «подобное растворяется в подобном», которое очень точно характеризует их область применения.